想要流式的染色結果好,需要用單細胞懸液,細胞團和細胞碎片容易堵塞進樣管。從固態組織樣本中制備單細胞懸液需要借助機械分離和(或者)酶消化。操作條件和酶的選擇等需要根據經驗進行一定的調整。以下是將四種常見的流式樣本制備成單細胞懸液的方法
一:組織培養細胞
所需試劑器皿:
1、 Accutase酶 (eBioscience Cat#00-4555)
2、 流式染色緩沖液(eBioscience Cat#00-4222)
3、 15或50ml離心管
單細胞懸液制備實驗步驟:
1、 對于懸浮生長的細胞,將細胞轉移至離心管中,進行計數和活力分析后進入第3步;
2、 對于貼壁生長的細胞系,我們建議用Accutase酶將細胞從培養皿中消化下來并分離聚集細胞。將細胞轉移至離心管中進行計數和活力分析后進入第3步(注意:Accutase酶會改變某些細胞的表面抗原表位);
3、 離心后,將細胞用流式染色緩沖液重懸至細胞濃度為2*10^7/ml。

二、淋巴組織細胞
一般來說機械分離淋巴組織足夠將細胞釋放為單細胞懸液。
單細胞懸液制備所需試劑器皿:
1、60mm×15mm的組織培養皿
2、3ml注射器
3、細胞過濾器(尼龍濾網)
4、流式染色緩沖液(eBioscience Cat#00-4222)
5、15或50ml離心管
單細胞懸液制備實驗步驟:
1、 將獲得的組織(脾臟、淋巴結、胸腺)放入到組織培養皿中,用3ml注射器活塞加壓的方法把組織分散為單細胞懸液(或者可以在10ml流式染色緩沖液總用兩片載玻片把組織壓成糊狀);
2、 用10ml流式染色緩沖液收集細胞,并將細胞懸液通過過濾器以除去細胞團和細胞碎片。將懸液收集到離心管中;
3、 4℃,300-400g離心細胞懸液4-5min,去除上清液;
4、 重懸沉淀細胞并做計數和活力分析;
5、 重復步驟3后,將細胞用流式染色緩沖液重懸至細胞濃度為2*10^7/ml。
三、非淋巴組織細胞
所需試劑器皿:
1、 剪刀或手術刀片
2、 PBS或其他合適的生理緩沖液
3、 60mm×15mm的組織培養皿
4、 3ml注射器
5、 細胞過濾器(尼龍濾網)
6、 流式染色緩沖液(eBioscience Cat#00-4222)
7、 15或50ml離心管
單細胞懸液制備實驗步驟:
1、 將組織用剪刀或手術刀片弄成2-4mm大小的碎塊;
2、 加入用PBS稀釋的適量的酶,應用合適孵育的時間和溫度參考所用酶的操作說明書(注意:酶的種類取決于組織的類型;
3、 用移液槍輕輕吹打分散細胞后,用過濾器過濾除去細胞團和碎片,收集細胞懸液至離心管中;
4、 4℃,300-400g離心細胞懸液4-5min,去除上清液;
5、 用PBS重懸細胞,去除多余的酶溶液;
6、 按步驟4的方法離心;
7、 重復步驟5和6;
8、 用流式染色緩沖液重懸細胞,并進行計數和活力分析;
9、 按步驟4的方法離心,將細胞用流式染色緩沖液重懸至細胞濃度為2*10^7/ml。
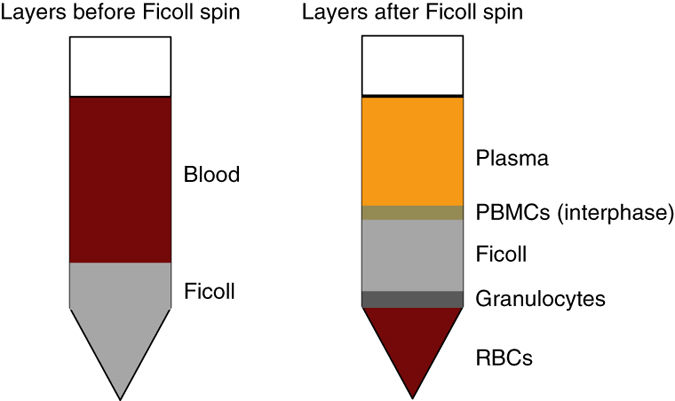
四、從全血中分離PBMC

所需試劑器皿:
1、 PBS
2、 Ficoll或者其他密度梯度分離液
3、 流式染色緩沖液(eBioscience Cat#00-4222)
4、 15或50ml離心管
單細胞懸液制備實驗步驟:

1、 將全血用PBS 1:1在錐形管中稀釋;
2、 在稀釋的樣本上面加入等體積的Ficoll;
3、 1000g離心20min;
4、 將位于PBS和Ficoll層間的PBMC轉移到一個新的管中;
5、 加入PBS清洗細胞;
6、 4℃,300-400g離心細胞懸液4-5min,去除上清液;
7、 用流式染色緩沖液重懸沉淀細胞并做計數和活力分析;
8、 重復步驟6后,將細胞用流式染色緩沖液重懸至細胞濃度為2*10^7/ml。
上一篇:上海凈信全國招商行動開啟
下一篇:單細胞RNA測序方法的比較分析